HALOGENY
F - fluor, Cl - chlor, Br - brom, I - jód
- 7. A skupina
- solitvorné prvky
- velmi reaktivní
- pouze ve sloučeninách
- biogenní prvky
Difúze bromu
- Nakapejte 5 - 10 kapek bromu do válce.
- Zakryjte zábrusovým sklem, několikrát překlopte.
- Když je bromem vyplněný celý válec, přiložte druhý válec, odstraňte zábrusové sklo a pozorujte difúzi par bromu.
Sublimace jódu
- Smíchejte jód a křemenný písek.
- Směsí vyplňte dno kádinky a postavte ji na trojnožku
- Položte varnou baňku s vodou na hrdlo kádinky, směs opatrně několik minut zahřívejte.
- Pozorujte páry jodu proti bílému pozadí.
- Před rozebráním nechte aparaturu vychladnout
Příprava chloru
Chemikálie:
manganistan draselný, konc. HCl, 20% roztok NaOH
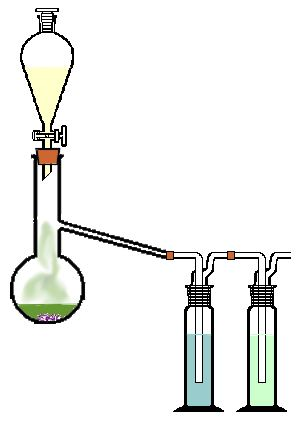
- Sestavte aparaturu pro vyvíjení plynu podle obrázku vpravo.
- Do baňky dejte 8 g KMnO4 a do dělicí nálevky nalijte 50 ml konc. HCl.
- Do první promývací baňky nalijte do 1/3 vodu.
Chlor se rozpouští a vzniká chlorová voda. - Do druhé promývací baňky nalijte 1/3 20% roztoku NaOH. Ta slouží k pohlcení zbytků chloru.
- Zkontrolujte těsnění aparatury.
- Začněte přikapávat kyselinu HCl.
Princip reakce:
2 KMnO4 + 16 HCl = 2 KCl + MnCl2 + 8 H2O + 5 Cl2
Poznámka:
Pro přípravu malého množství chloru (1 l): 2,8 g
manganistanu draselného navažte do porcelánového kelímku, vložte do preparačního
válce, pipetou přilijte 13 ml koncentrované kyseliny
chlorovodíkové, válec přikryjte zábrusovým sklem.
Pozorujte unikající chlor.

Odbarvovací účinky chloru
Do válce obsahujícího chlor vložte květinu.
Vzájemné vytěsňování halogenů z halogenidů
- Připravte si roztoky chloridu sodného, bromidu draselného a jodidu draselného.
- Budete potřebovat chlorovou vodu, bromovou vodu a Lugolův roztok.
- Reakce provádějte ve zkumavkách.
Je vhodné připravit tabulku, viz níže.
Princip reakce:
Reaktivita halogenů klesá ve skupině. Halogen nacházející se výš ve skupině vytěsní halogen níže ze skupiny. Nejreaktivnějším halogenem je fluor.

Chemikálie:
inkoust, savo = obsahuje chlornan
Odbarvení inkoustu
- Vodu v kádince obarvěte inkoustem
- Přilévejte chlorovou vodu (savo).
- Pozorujte.
Poznámka:
Podobně barvení textilu savem.
Duha v rajčatové šťávě
Chemikálie:
roztok bromové vody, rajčatová šťáva
- Do poloviny výšky odměrného válce nalijte rajčatovou šťávu.
- Přidejte cca stejné množství čerstvě připravené bromové vody.
- Skleněnou tyčinkou důkladně promíchejte.
- Zhruba za 1 minutu pozorujte barevné změny.
Chemikálie:
vlažná
voda, jod, práškový hliník
Voda zapaluje
- Ve třecí misce důkladně promíchejte směs jodu s práškovým hliníkem v hmotnostním poměru 6:1. (třecí miska musí být 100% suchá)
- Směs dejte do porcelánové misky.
- Přikápněte 2 - 3 kapky teplé vody.
- Pozorujte.
Princip reakce:
Hliník reaguje s jodem za vzniku jodidu hlinitého - tato reakce je katalyzována vodou. Reakce je exotermická, uvolňuje se teplo, které způsobuje, že část jodu sublimuje, a proto lze pozorovat fialové páry plynného jodu.
Zlatý déšť
- 0,33 g dusičnanu olovnatého rozpusťte ve 100 ml vody (pokud se tvoří zákal, přidejte několik kapek kyseliny dusičné)
- 0,33 g jodidu draselného rozpusťte v 100 ml vody.
- Oba roztoky zahřejte k varu a slijte do baňky.
- Baňku ochlaďte proudem studené vody.
Krystalky oddělte filtrací.
Princip reakce:
Dusičnan olovnatý s jodidem draselným spolu reagují za vzniku jodidu olovnatého a dusičnanu draselného.
Rozpustnost jodidu olovnatého ve vodě závisí na teplotě, za vyšší
teploty je rozpustný, za nižší teplotě je nerozpustný - pozorujeme žluté
krystalky.
Chemikálie:
voda,
jodid draselný, dusičnan olovnatý, kyselina dusičná, ethanol

Princip reakce:
KCl + H2SO4 = HCl + KHSO4
Silná kyselina reaguje se slabšími kyselinami a vytěsňuje z nich halogenid, zároveň vznikají plyny halogenvodíky.
Vytěsňování halogenvodíků z halogenidů
- Do tří zkumavek dejte jednotlivé halogenidy
(chlorid, bromid, jodid). - Přidejte 3 ml konc. kys. sírové.
- Sledujte průběh reakcí a pomocí navlhčeného pH papírku zkoumejte pH u ústí zkumavky.
Prováděje v digestoři!
Reakce chlorovodíku s amoniakem
Chemikálie:
amoniak, chlorovodíková kyselina
Varianta A

- Nad kádinkou s 1 ml konc. roztoku amoniaku přidržte tyčinku omočenou v konc. kys. chlorovodíkové.
Princip reakce:
NH3 + HCl -> NH4Cl
salmiak = dým (PL v plynu)
Varianta B
- Pod skleněnou vanu umístěte dvě hodinová sklíčka.
- Na jedno přidejte několik kapek konc. roztoku kys. chlorovodíkové, na druhé několik kapek konc. roztoku amoniaku.
Ideální je použít tmavou podložku.
Princip reakce:
Graham-Bunsenův zákon - vztah mezi molární hmotností a rychlostí reakce.
HCl je těžší a pohybuje se pomaleji, dým se tvoří nad sklíčkem s HCl, NH3 se pohybuje rychleji.
Varianta C
- Do stojanu upevněte vodorovně dlouhou skleněnou tyč (1 m).
- Do jednoho konce vložte chomáč vaty navlhčený konc. kys. chlorovodíkovou a do druhého konce chomáč navlhčený konc. roztokem amoniaku.
Oba konce uzavřete pryžovými zátkami. Pozorujte a popište jev.
nh
Princip reakce:
Graham-Bunsenův zákon - vztah mezi molární hmotností a rychlostí reakce.
HCl je těžší a pohybuje se pomaleji, dým se tvoří nad HCl, NH3 se pohybuje rychleji
Termický rozklad chloridu amonného
Chemikálie:
pevný chlorid amonný
- Do zkumavky vložte jednu malou lžičku pevného chloridu amonného a asi do poloviny vložte načechraný chomáč vaty, který ve zkumavce přidržuje navlhčené 2 lakmusové papírky / pH papírky (modrý dole, červený nahoře).
- Zkumavku upevněte šikmo (60°C) do stojanu a chlorid amonný několik minut mírně zahřívejte lihovým kahanem, dokud nejsou pozorovatelné změny - zbarvení papírků.